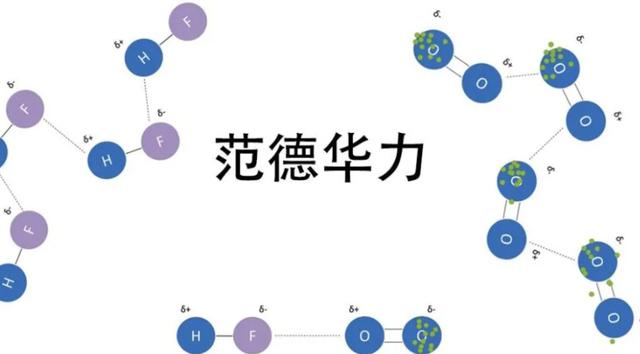
范德华力是分子间作用力,但是它的本源是分子外层电子之间的静电作用力.
范德华力有三个来源:
1)静电力(可以理解为静止静电力)
2)色散力
3)诱导力
这3个力都是来源于电子间静电作用.
如果想了解更详细的内容,可以继续询问.
范德华力包括哪三种力
没有。
分子间力(即范德华力)包括色散力、诱导力和取向力三种。作用的原因都是同种电荷之间相互吸引,异种电荷之间排斥。但是电荷的由来不同。
取向力只存在于极性分子之间,作用成因是固有偶极之间的静电吸引。
例如:水与氯代甲烷。
水的氢原子上略带正电,氧略带负电。
这种正负电荷中心不重合是水分子固有的。
氯代甲烷也一样,氯上略带负电,甲基上略带正电。
它们遇到一起,就会像磁铁那样取向:同种电荷互相远离,异种电荷互相接近。
(水的氢会向氯靠拢,氧会向甲基靠拢)作用的结果只是分子转到了相对固定的方向(即取向),所以叫取向力。
诱导力存在于:极性分子与非极性分子,或者2个极性分子之间。作用成因是固有偶极与诱导偶极的静电吸引。
例如:二硫化碳和水。
二硫化碳本来不带极性,但是由于水是有极性的,水中的氢会吸引二硫化碳中的电子云,水中的氧会排斥二硫化碳中的电子云。
由此使得二硫化碳带上了临时的偶极。
(就像感应带电那样)这种偶极是被诱导出来的,所以叫诱导偶极。
诱导偶极与固有偶极之间的作用就叫诱导力。
极性分子也可以诱导另一个极性分子,所以极性分子也可以产生诱导力。
如果被诱导产生偶极的分子,远离了极性分子,诱导偶极就会消失,所以诱导力不如取向力大。
色散力存在于:各种分子间(极性分子与非极性分子,或者2个极性分子之间,或者2个非极性分子间。)作用成因是瞬时偶极与瞬时偶极的静电吸引。
非极性分子也有电子云的震动,其瞬间的会产生电子云中心与正电荷中心不重合,这样就会产生瞬时偶极。瞬时偶极也有相互吸引或排斥,形成作用。但是瞬时的偶极很快就会消失,所以色散力最小。
由于各种分子的电子云都是动态的,都有振动,所以都会产生色散力。
非极性分子之间只有色散力,色散力又比较弱,所以非极性分子间作用最小,熔点就比较低。
非极性分子与极性分子之间多了诱导力,作用加强,所以熔点会上升。
极性分子之间又多了取向力,作用最强,所以相对熔点最高。









还没有评论,来说两句吧...