范德华力和氢键的区别是形成不同。
范德华力是分子间力,和分子间距有关,和分子极性大小和分子质量大小有关,氢键是H原子和其他原子结合的力,范德华力包括色散力,诱导力,取向力三种。
分子间作用力不属于化学键,主要包括氢键,范德华力等。我们又规定氢键不属于范德华力,氢键作用力要强于范德华力而弱于离子键作用力。
形成不同氢键:在蛋白质的a-螺旋的情况下是N-H…O型的氢键,DNA的双螺旋情况下是N-H…O,N-H…N型的氢键,因为这些结构是稳定的,所以这样的氢键很多。
此外,水和其他溶媒是异质的,也由于在水分子间生成O-H—…O型氢键。
因此,这也就成为疏水结合形成的原因,范德华力:极性分子的永久偶极矩之间的相互作用,一个极性分子使另一个分子极化,产生诱导偶极矩并相互吸引。
作用力不同氢键:氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(OFN等)接近,在X与Y之间以氢为媒介。
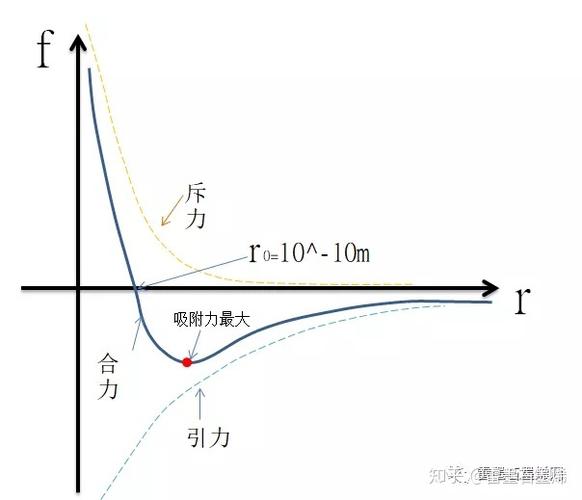
生成X-H…Y形式的一种特殊的分子间或分子内相互作用,范德华力:分子间作用力只存在于分子(molecule)与分子之间或惰性气体(noblegas)原子(atom)间的作用力。
化学键、氢键、和范德华力的区分
范德华力是分子间力,和分子间距有关,和分子极性大小和分子质量大小有关,氢键是H原子和其他原子结合的力。
范德华力包括色散力,诱导力,取向力三种,分子间作用力不属于化学键,主要包括氢键,范德华力等,我们又规定氢键不属于范德华力,氢键作用力要强于范德华力而弱于离子键作用力。
范德华力包括哪三种力强弱顺序
hcl和h2o之间存在的分子间作用力没有的是(氢键)。
分子间作用力,又称范德华力(vanderWaalsforce)。
分子间作用力(范德华力)有三个来源:极性分子的永久偶极矩之间的相互作用。
一个极性分子使另一个分子极化,产生诱导偶极矩并相互吸引。
分子中电子的运动产生瞬时偶极矩,它使邻近分子瞬时极化。
后者又反过来增强原来分子的瞬时偶极矩;这种相互耦合产生静电吸引作用,这三种力的贡献不同,通常第三种作用的贡献最大。
分子间作用力只存在于分子(molecule)与分子之间或惰性气体(noblegas)原子(atom)间的作用力,又称范德华力(vanderwaals),具有加和性。
氢键(hydrogenbond)、弱范德华力、疏水作用力、芳环堆积作用、卤键都属于次级键(又称分子间弱相互作用)。
三种力的关系极性分子与极性分子之间,取向力、诱导力、色散力都存在;极性分子与非极性分子之间,则存在诱导力和色散力。
非极性分子与非极性分子之间,则只存在色散力。这三种类型的力的比例大小,决定于相互作用分子的极性和变形性。极性越大,取向力的作用越重要;变形性越大,色散力就越重要;诱导力则与这两种因素都有关。
但对大多数分子来说,色散力是主要的。实验证明,对大多数分子来说,色散力是主要的;只有偶极矩很大的分子(如水),取向力才是主要的;而诱导力通常是很小的。极化率α反映分子中的电子云是否容易变形。
虽然范德华力只有0.4—4.0kJ/mol,但是在大量大分子间的相互作用则会变得十分稳固。
比如C—H在苯中范德华力有7kJ/mol,而在溶菌酶和糖结合底物范德华力却有60kJ/mol,范德华力具有加和性。









还没有评论,来说两句吧...