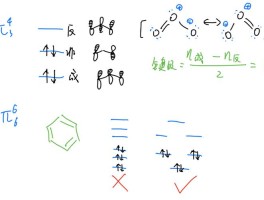
电负性的比较:1、同一周期,原子序数越大,电负性的值越大。
2、同一主族,院子序数越大,电负性的值越小。
3、不同主族、不同周期的元素之间的比较,很复杂,无法得出一个简单判断法。
通常采用的是Pauling法跟Allen法,尤其是Pauling法。
就简单记吧周期表中,同主族金属性从上向下依次增强,同周期非金属性从左至右依次增强,非金属性越强的当然电负性值也越大,金属性越强当然第一电离能的值越小。
如果既不是同周期,也不是同主族,一般氧化性都是右上比左下强。
如果是左上与右下的关系只能查表比较。
电负性的比较
在这两张数据表上,都是S的电负性数值大于C,所以S原子更吸引电子,。
更容易得到电子。
电负性是元素的原子在化合物中吸引电子的能力的标度。
1、元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。
又称为相对电负性,简称电负性,也叫电负度。
电负性综合考虑了电离能和电子亲合能,用来表示两个不同原子间形成化学键时吸引电子能力的相对强弱,是元素的原子在分子中吸引共用电子的能力。
通常以希腊字母χ为电负性的符号。
2、鲍林给电负性下的定义为“电负性是元素的原子在化合物中吸引电子能力的标度”。
元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外)。
3、电负性是一个物理概念,确立概念和建立标度常常是两回事。同一个物理量,标度不同,数值不同。
4、电负性是相对值,所以没有单位。而且电负性的计算方法有多种(即采用不同的标度),因而每一种方法的电负性数值都不同,所以利用电负性值时,必须是同一套数值进行比较。
b和h的电负性怎么判断
判断分子中化学键的极性与非极性通常可以使用一些简单的口诀帮助记忆。以下是两个常用的口诀:
1."EN值相减,决定极性"。
这个口诀是根据元素的电负性(Electronegativity,简称EN)来判断化学键的极性。如果化学键中两个原子的电负性相差较大,那么该键就是极性键;如果电负性相差较小,那么该键就是非极性键。
电负性差异较大的键一般是极性键,电负性差异较小的键一般是非极性键。
2."碳氧亲家非常幸福"。
这个口诀是针对一些常见分子中的键进行判断。
其中,C表示碳,O表示氧。
如果化学键是碳-氧键(例如C-O、CO₂等),那么它是极性键;如果化学键是碳-碳键(例如C-C、CH₄等),那么它是非极性键。
这两个口诀是简单而实用的判断极性键与非极性键的方法,但并不适用于所有情况。
在更复杂的分子中,需要根据各个原子的电负性来综合判断键的极性。
同时,实际的分子形式也可能受到共振、空间位阻等因素的影响,使得分子中的键的极性更复杂。
因此,在判断分子键的极性时,需要综合考虑多种因素。








还没有评论,来说两句吧...