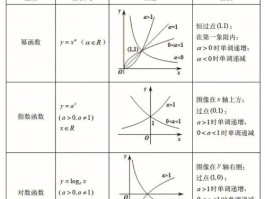
阿伦尼乌斯公式(Aronhold'sformula)是一个与三角函数和三角恒等式相关的重要公式。它的意义在于提供了三角函数的乘积与和差的关系。
阿伦尼乌斯公式表述如下:
sin(A±B)=sin(A)cos(B)±cos(A)sin(B)。
其中A和B是任意角度。
指数式(Exponentialform):阿伦尼乌斯公式没有直接的指数形式,因为它涉及三角函数而非指数函数。
微分式(Differentialform):阿伦尼乌斯公式在微分式中的应用较少见,因为它主要关注角度和三角函数之间的关系,而非导数。
定积分式(Definiteintegralform):阿伦尼乌斯公式的定积分形式可用于求解一些特定的三角函数积分。
具体来说,可以将定积分应用于阿伦尼乌斯公式右侧的各项,从而推导出一些特定的三角函数积分公式。
不定积分式(Indefiniteintegralform):阿伦尼乌斯公式的不定积分形式通常用于求解一些特定的三角函数积分。
通过将不定积分应用于阿伦尼乌斯公式右侧的各项,我们可以推导出一些特定的三角函数积分表达式。
这些结果在解决与三角函数相关的问题时非常有用。
阿伦尼乌斯公式A的值
阿伦尼乌斯公式是用于描述化学反应速率与温度之间关系的公式。
它表达了反应速率常数(k)与绝对温度(T)之间的关系,公式为k=Ae^(-Ea/RT),其中A为指前因子,Ea为活化能,R为气体常数,T为绝对温度。
阿伦尼乌斯公式的核心在于它揭示了温度对化学反应速率的影响机制。
在公式中,活化能Ea是一个关键参数,它表示反应物分子转化为活化态所需的最小能量。
Ea的值越大,反应所需的活化能越高,反应速率就越慢。
而指前因子A则与反应本身的性质有关,包括反应物浓度、碰撞频率等因素。
公式的指数部分e^(-Ea/RT)描述了温度对反应速率的影响。
随着温度的升高,分子的热运动加剧,碰撞频率和能量增加,使得反应更容易进行。
这种影响在公式中通过指数函数的形式表现出来,当温度升高时,e^(-Ea/RT)的值增大,从而提高了反应速率常数k。
以一个简单的例子来说明阿伦尼乌斯公式的应用。假设有两个化学反应A和B,它们的活化能分别为Ea1和Ea2,且Ea1。
总之,阿伦尼乌斯公式是一个重要的化学动力学公式,它定量描述了温度对化学反应速率的影响。
通过理解这个公式,我们可以更好地预测和控制化学反应的速率,从而在实际应用中实现更高效、更安全的化学反应过程。









还没有评论,来说两句吧...