电负性越大非金属性越强,否则非金属性越弱,即金属性越强。化学中规定氟的电负性为3.98,其他元素与其相比较,而具有相对的电负性。
电负性大于1.8的是非金属元素,小于1.8的是金属元素,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外)。
电负性也可以作为判断元素的金属性和非金属性强弱的尺度。
一般来说,电负性大于1.8的是非金属元素,小于1.8的是金属元素,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减。对副族而言,同族元素的电负性也大体呈现这种变化趋势。因此,电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角。
电负性越大的非金属元素越活跃,电负性越小的金属元素越活泼。氟的电负性最大(4.0),是最容易参与反应的非金属;电负性最小的元素(0.79)铯是最活泼的金属。
电负性相同的非金属元素化合形成化合物时,形成非极性共价键,其分子都是非极性分子;通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。
电负性大小顺序表
由元素在周期表中位置,可知A为硼、B为碳、C为氮、D为氧、E为氟、F为Na、G为Si、Z为Cl、I为Ca、M为Cu.。
(1)非金属性F>Cl>C>Si,非金属性越强,电负性越大,故电负性:F>Cl>C>Si,故答案为:F>Cl>C>Si;
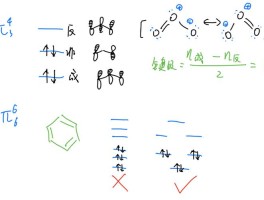
(2)同周期自左而右第一电离能呈增大趋势,N原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故上述元素中,第一电离能:F>N>O>C>B,介于B与N元素之间的有2种;
BCl3中B原子价层电子对数=3+2 2
由原子半径可知,大球为B原子,小球为N原子,晶胞中B原子数目=1+8×8 4
故答案为:2;sp2;sp3;1:1;BN;4;N;
(3)NaCl晶体中离子配位数为6,为图2中的a图,晶胞中钠离子数目=氯离子数目=1+12×4 8
在CaF2的晶胞中,每个钙离子周围有8个氟离子,配位数为8;
故答案为:a;
(4)Cu原子的价层电子排布式为3d104s1,价层电子排布图为;
Cu原子在三维空间以面心立方最密堆积的方式形成晶体,晶胞中Cu原子数目=8×8 2 3 相关阅读
发表评论









还没有评论,来说两句吧...