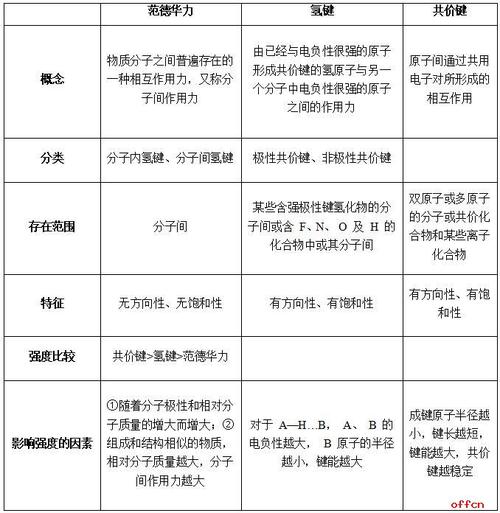
范德华力是分子间普遍存在的作用力,它很弱,比化学键的键能小1~2个数量级。
对于结构相似的物质,相对分子质量越大,范德华力越大;分子的极性越大,范德华力越大。
范德华力主要影响物质的物理性质,范德华力越大,物质的熔沸点越高。
分子间作用力大小判断
1、极性分子的永久偶极矩之间的相互作用。
2、一个极性分子使另一个分子极化,产生诱导偶极矩并相互吸引。
3、分子中电子的运动产生瞬时偶极矩。
另外,分子量越大,分子内所含电子数越多的分子色散力较大;各原子核的外层电子壳越大,诱导力越大;分子极性越大,取向力越大。
氢键对物质性质的影响
(1)熔沸点
氢键的存在大大增强了分子间的作用力,引起熔沸点的反常。
如水、氟化氢、氨气的沸点比同主族其他元素的氢化物的沸点高很多。
但是分子内氢键的存在减弱了分子间的相互作用,反而使物质的熔沸点降低。
(2)密度
水结冰时体积膨胀、密度减小也是由于氢键的原因。
(3)溶解性
如果溶质与溶剂之间能形成氢键,则溶解度增大,并且氢键作用力越大,溶解性越好。如氨气极易溶于水,乙醇能与水以任意比例互溶。
范德华力的实质是什么作用
恩!是电磁力。
范德华力是存在于分子间的一种吸引力,它比化学键弱得多。一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。
分子间力有三种来源,即色散力、诱导力和取向力。
色散力是分子的瞬时偶极间的作用力,它的大小与分子的变形性等因素有关。
一般分子量愈大,分子内所含的电子数愈多,分子的变形性愈大,色散力亦愈大。
诱导力是分子的固有偶极与诱导偶极间的作用力,它的大小与分子的极性和变形性等有关。
取向力是分子的固有偶极间的作用力,它的大小与分子的极性和温度有关。
极性分子的偶极矩愈大,取向力愈大;温度愈高,取向力愈小.
在物质的聚集态中,分子间存在着一种较弱的吸引力,作用能的大小一般只有每摩尔几千焦至几十千焦,比化学键的键能小1~2个数量级,亦称范德华引力或范氏力。
它由三部分作用力组成:①当极性分子相互接近时,它们的固有偶极将同极相斥而异极相吸,定向排列,产生分子间的作用力,叫做取向力。
偶极矩越大,取向力越大。
②当极性分子与非极性分子相互接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,产生诱导偶极,然后诱导偶极与固有偶极相互吸引而产生分子间的作用力,叫做诱导力。
当然极性分子之间也存在诱导力。
③非极性分子之间,由于组成分子的正、负微粒不断运动,产生瞬间正、负电荷重心不重合,而出现瞬时偶极。
这种瞬时偶极之间的相互作用力,叫做色散力。
分子量越大,色散力越大。
当然在极性分子与非极性分子之间或极性分子之间也存在着色散力。
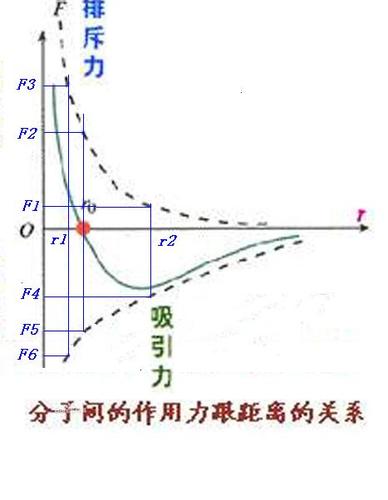
范德华引力是存在于分子间的一种不具有方向性和饱和性,作用范围在几百个皮米之间的力。
它对物质的沸点、熔点、气化热、熔化热、溶解度、表面张力、粘度等物理化学性质有决定性的影响。
所以它是一种分子之间相互吸引的力,而出现在极性于非极性分之间,那么极性于非极性分子的区别也就在于电子云分布的不同,所以范德华力是一种电磁力。









还没有评论,来说两句吧...