第三章氨基酸代谢
一、营养必需氨基酸
简记为:缬、异、亮、苏、蛋、赖、苯、色
二、体内氨的来源和转运
1、来源
1)氨基酸经脱氨基作用产生的氨是体内氨的主要来源;
2)由肠道吸收的氨;即肠内氨基酸在肠道细菌作用下产生的氨和肠道尿素经细菌尿素酶水解产生的氨。
3)肾小管上皮细胞分泌的氨主要来自谷氨酰胺在谷氨酰胺酶的催化下水解生成的氨。
2、转运
1)丙氨酸-葡萄糖循环
(肌肉)(血液)(肝)
肌肉蛋白质葡萄糖葡萄糖葡萄糖尿素
氨基酸糖糖尿素循环
分异
NH3解生NH3
谷氨酸丙酮酸丙酮酸谷氨酸
转氨酶转氨酶
α-酮戊二酸丙氨酸丙氨酸丙氨酸α-酮戊二酸。
2)谷氨酰胺的运氨作用
谷氨酰胺主要从脑、肌肉等组织向肝或肾运氨。氨与谷氨酰胺在谷氨酰胺合成酶催化下生成谷氨酰胺,由血液输送到肝或肾,经谷氨酰胺酶水解成谷氨酸和氨。
可以认为,谷氨酰胺既是氨的解毒产物,也是氨的储存及运输形式。
三、氨基酸的脱氨基作用
1、转氨基作用转氨酶催化某一氨基酸的α-氨基转移到另一种α-酮酸的酮基上,生成相应的氨基酸;原来的氨基酸则转变成α-酮酸。
既是氨基酸的分解代谢过程,也是体内某些氨基酸合成的重要途径。
除赖氨酸、脯氨酸及羟脯氨酸外,体内大多数氨基酸可以参与转氨基作用。
如:
谷氨酸+丙酮酸谷丙转氨酶(ALT)α-酮戊二酸+丙氨酸。
谷氨酸+草酰乙酸谷草转氨酶(AST)α-酮戊二酸+天冬氨酸。
转氨酶的辅酶是维生素B6的磷酸酯,即磷酸吡哆醛。
2、L-谷氨酸氧化脱氨基作用
L-谷氨酸L-谷氨酸脱氢酶α-酮戊二酸+NH3。
NADH
3、联合脱氨基作用
氨基酸α-酮戊二酸NH3+NADH
转氨酶谷氨酸脱氢酶
α-酮酸谷氨酸NAD+
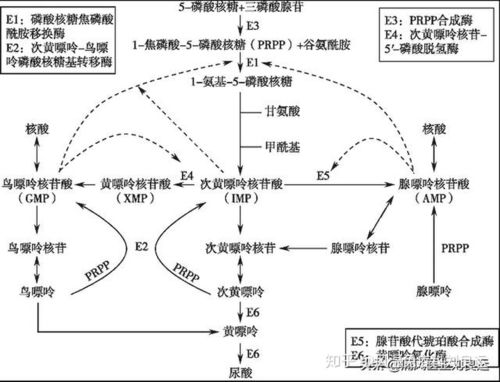
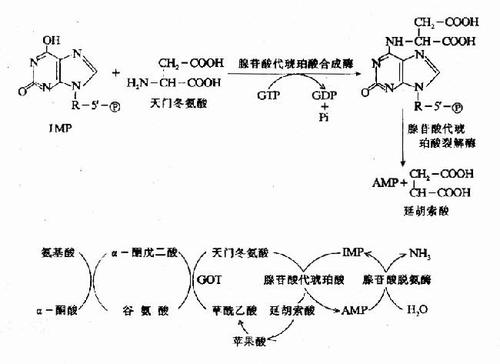
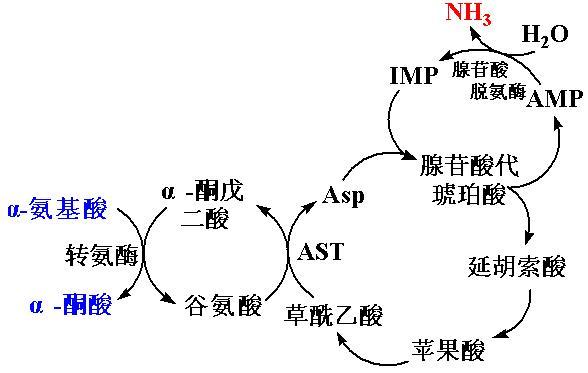
4、嘌呤核苷酸循环
上述联合脱氨基作用主要在肝、肾等组织中进行。骨骼肌和心肌中主要通过嘌呤核苷酸循环脱去氨基。
氨基酸α-酮戊二酸天冬氨酸次黄嘌呤核苷酸NH3。
GTP(IMP)
腺苷酸代琥珀酸腺嘌呤核苷酸
(AMP)
延胡索酸
α-酮酸L-谷氨酸草酰乙酸
苹果酸
5、氨基酸脱氨基后生成的α-酮酸可以转变成糖及脂类,在体内可以转变成糖的氨基酸称为生糖氨基酸;能转变成酮体者称为生酮氨基酸;二者兼有者称为生糖兼生酮氨基酸。
只要记住生酮氨基酸包括:亮、赖;生糖兼生酮氨基酸包括异亮、苏、色、酪、苯丙;其余为生糖氨基酸。
四、氨基酸的脱羧基作用
1、L-谷氨酸L-谷氨酸脱羧酶γ-氨基丁酸(GABA)。
GABA为抑制性神经递质。
2、L-半胱氨酸磺酸丙氨酸磺酸丙氨酸脱羧酶牛磺酸。
牛磺酸是结合型胆汁酸的组成成分。
3、L-组氨酸组氨酸脱羧酶组胺
组胺是一种强烈的血管舒张剂,并能增加毛细血管的通透性。
4、色氨酸色氨酸羟化酶5-羟色氨酸5-羟色氨酸脱羧酶5-羟色胺(5-HT)。
脑内的5-羟色胺可作为神经递质,具有抑制作用;在外周组织,有收缩血管作用。
5、L-鸟氨酸鸟氨酸脱羧酶腐胺精脒精胺
脱羧基SAM脱羧基SAM
精脒与精胺是调节细胞生长的重要物质。合称为多胺类物质。
五、一碳单位
一碳单位来源于组、色、甘、丝,体内的一碳单位有:甲基、甲烯基、甲炔基、甲酰基及亚氨甲基,CO2不属于一碳单位。
四氢叶酸是一碳单位代谢的辅酶。
主要生理功用是作为合成嘌呤及嘧啶的原料。
如N10-CHO-FH4与N5,H10=CH-FH4分别提供嘌呤合成时C2与C8的来源;N5,N10-CH2-FH4提供胸苷酸合成时甲基的来源。
由此可见,一碳单位将氨基酸与核酸代谢密切联系起来。
六、芳香族氨基酸(色、酪、苯丙)的代谢
1、苯丙氨酸
苯丙氨酸羟化酶
酪氨酸黑色素细胞的酪氨酸酶多巴
酪氨酸羟化酶
多巴黑色素
多巴脱羧酶
多巴胺
SAM去甲肾上腺素儿茶酚胺
肾上腺素
嘌呤核苷酸循环脱氨基作用主要在哪个组织中进行
脱氨基作用,细胞内从有机化合物分子上除去氨基的酶促反应,是机体内氨基酸代谢的第一步.脱氨基作用有氧化脱氨,转氨,联合脱氨和非氧化脱氨等方式.其中以联合脱氨基最为重要.氧化脱氨基作用普遍存在于动植物细胞中,动物的脱氨基作用主要在肝脏进行;非氧化脱氨基作用见于微生物,但并不普遍.生物中许多含氨基的化合物在分解代谢过程里几乎都有这类反应.这些化合物包括各种氨基酸、腺嘌呤、鸟嘌呤、胞嘧啶及它们的衍生物.脱氨基作用是由各种脱氨酶催化的,反应产物是对应的酮基化合物.在氨基酸的分解代谢中,L-谷氨酸的氧化性脱氨作用很重要.因为在许多生物中只有谷氨酸一种氨基酸能进行氧化性脱氨,催化这一反应的谷氨酸脱氢酶的专一性又较高.现在认为,至少在动物体内,大部分氨基酸是通过氨基转换和谷氨酸氧化脱氨的联合作用脱氨的,也可通过此联合作用的逆反应合成某些氨基酸.
氧化脱氨基作用是指氨基酸在脱氨基时伴有氧化(脱氢)过程.
催化氧化脱氨基的酶有氨基酸氧化酶和L-谷氨酸脱氢酶.L-谷氨酸脱氢酶是以NAD+(或NADP+)为辅酶的不需氧脱氢酶,其在体内分布广(除肌肉组织外)、活性强,能催化L-谷氨酸氧化脱氨,生成α-酮戊二酸.
L-谷氨酸脱氢酶的催化反应是可逆的.当谷氨酸浓度高时,则向分解方向进行.由于L-谷氨酸脱氢酶的底物仅限于L-谷氨酸,因此不是体内理想的脱氨基过程.
氨基转移作用在各组织细胞普遍存在.催化转氨基作用的酶,称为氨基转移酶或简称转氨酶.它的作用是使氨基酸的α-氨基转移至另一α-酮酸的羰基上.
氨基转移酶的辅酶是吡哆胺磷酸和吡哆醛磷酸,它们作为氨基传递体而起作用。
氨基转移作用也是可逆反应,除个别几个氨基酸如赖氨酸、苏氨酸、脯氨酸、羟脯氨酸外,其他氨基酸都可参与氨基的转移作用.只要体内存在相应的酮酸,就可合成某种氨基酸,这是体内合成非必需氨基酸的主要途径.丙氨酸:α-酮戊二酸氨基转移酶(称谷丙转氨酶(GPT),又称丙氨酸转氨酶(ALT))和天冬氨酸:α-酮戊二酸氨基转移酶(称谷草转氨酶(GOT)、又称天冬氨酸转氨酶(AST))两种酶很重要.
健康成人各组织中GOT和GPT活性
━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━。
组织名称GOTGPT
单位/每克湿组织单位/每克湿组织
──────────────────────────────
心脏1560007100
肝脏14200044000
骨骼肌990004800
肾脏9100019000
胰腺280002000
脾脏140001200
肺脏10000700
血清2016
━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━。
氨基转移作用只是将一个氨基酸的氨基转移到另一酮酸上生成氨基酸,并没有真正脱去氨基.各种氨基酸都可将氨基转移到α-酮戊二酸生成谷氨酸.谷氨酸脱氢酶活性强,分布广(除肌肉组织外),因此在体内脱氨基作用,主要是通过联合脱氨[基]作用来实现的.由于谷氨酸脱氢酶在肌肉组织中含量很低活性又弱,难于进行联合脱氨基作用.现已知在肌肉组织中,氨基酸与α-酮戊二酸经转氨基生成谷氨酸后,是通过嘌呤核苷酸循环过程脱去氨基,生成天冬氨酸,天冬氨酸与肌苷酸(又称次黄嘌呤核苷酸)反应生成腺苷酸基琥珀酸(又称腺苷酸代琥珀酸),后者经裂解为延胡索酸和腺嘌呤核苷酸,腺嘌呤核苷酸水解脱氨,又回到肌苷酸.延胡索酸则经苹果酸生成草酰乙酸.肌苷酸和草酰乙酸都可重新参与循环反应.
在生物体内,除上述主要脱氨基方式外,个别氨基酸还可通过其它脱氨基方式.如丝氨酸的脱水脱氨基作用,天冬氨酸直接脱氨基作用和半胱氨酸的脱硫化氢脱氨基作用等.










还没有评论,来说两句吧...