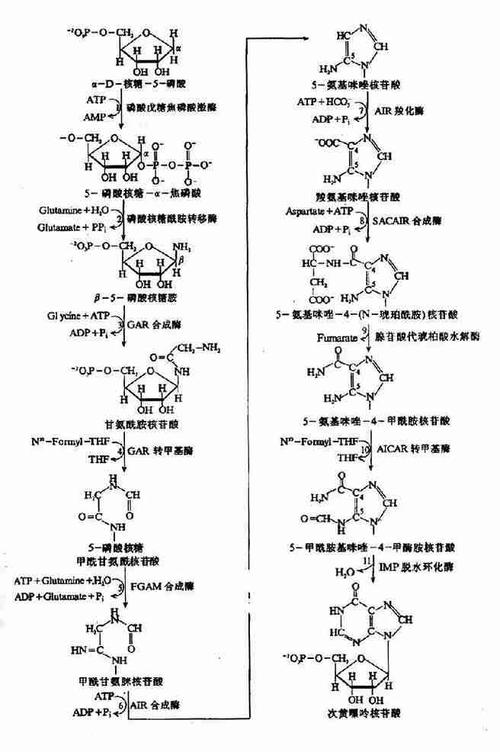
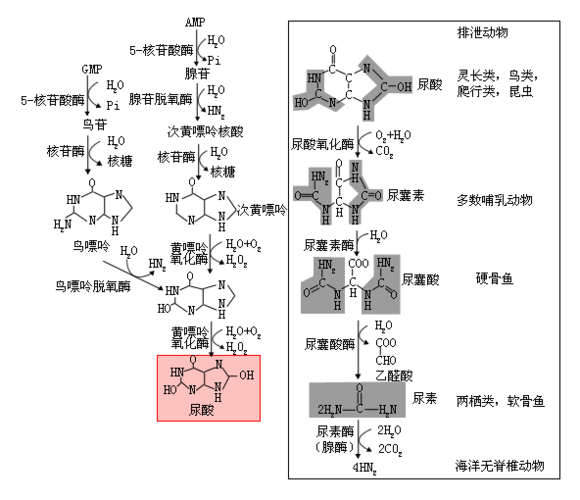
嘌呤核苷酸循环脱氨基作用主要在哪些组织中进行。
氨基作用是氨基酸分解代谢的主要途径.体内的氨基酸可通过多种方式脱去氨基,包括氧化脱氨基作用、转氨基作用、联合脱氨基作用及嘌呤核苷酸循环,其中联合脱氨基作用是氨基酸脱氨基的主要方式.所谓联合脱氨基,是指氨基酸的转氨基作用和氧化脱氨基作用的联合,其过程是氨基酸首先与α-酮戊二酸在转氨酶催化下生成相应的α-酮酸和谷氨酸,谷氨酸在L-谷氨酸脱氢酶作用下生成α-酮戊二酸和氨,α-酮戊二酸再继续参与转氨基作用.上述联合脱氨基作用是可逆的,所以也是体内合成非必需氨基酸的主要途径.催化氨基酸转氨基的酶是转氨酶,其辅酶是维生素B6的磷酸酯即磷酸吡哆醛和磷酸吡哆胺,此酶催化某一氨基酸的α氨基转移到另一种α酮酸的酮基上,生成相应的氨基酸.体内有多种转氨酶,其中谷丙转氨酶(GPT或ALT)和谷草转氨酶(GOT或AST)最为重要.由于骨骼肌和心肌中L-谷氨酸脱氢酶的活性弱,难于进行联合脱氨基作用,该组织的氨基酸主要通过嘌呤核苷酸循环进行脱氨基作用.嘌呤核苷酸循环过程,氨基酸首先通过连续的转氨基作用将氨基转移给草酰乙酸,生成天冬氨酸;天冬氨酸与次黄嘌呤核苷酸生成腺苷酸带琥珀酸,经裂解生成AMP,AMP在腺苷酸脱氨酶催化下脱去氨基.由此可见,嘌呤核苷酸循环实际上也可以看成是另一种形式的联合脱氨基作用.
嘌呤核苷酸循环主要在哪些组织中进行
氨基酸是构成蛋白质分子的基本单位。
蛋白质是生命活动的基础。
体内的大多数蛋白质均不断地进行分解与合成代谢,细胞中不停地利用氨基酸合成蛋白质和分解蛋白质成为氨基酸。
体内的这种转换过程一方面可清除异常蛋白质,这些异常蛋白质的积聚会损伤细胞。
另一方面使酶或调节蛋白的活性由合成和分解得到调节,进而调节细胞代谢。
实际上酶的水平取绝于其合成同样也由酶的分解来决定。
所以,对细胞来说,蛋白质的分解与合成同样重要。
�。
蛋白质分解代谢首先在酶的催化下水解为氨基酸,而后各氨基酸进行分解代谢,或转变为其它物质、或参与新的蛋白质的合成。因此氨基酸代谢是蛋白质分解代谢的中心内容。�。
食物蛋白经过消化吸收后,以氨基酸的形式通过血液循环运到全身的各组织。
这种来源的氨基酸称为外源性基酸。
机体各组织的蛋白质在组织酶的作用下,也不断地分解成为氨基酸;机体还能合成部分氨基酸(非必需氨基酸);这两种来源的氨基酸称为内源性氨基酸。
外源性氨基酸和内源性氨基酸彼此之间没有区别,共同构成了机体的氨基酸代谢库(metabolic。
pool)。氨基酸代谢库通常以游离氨基酸总量计算,机体没有专一的组织器官储存氨基酸,氨基酸代谢库实际上包括细胞内液、细胞间液和血液中的氨基酸。�。
氨基酸的主要功能是合成蛋白质,也合成多肽及其他含氮的生理活性物质。
除了维生素之外(维生素PP是个例外)体内的各种含氮物质几种都可由氨基酸转变而成,包括蛋白质、肽类激素、氨基酸衍生物、黑色素、嘌呤碱、嘧啶碱、肌酸、胺类、辅酶或辅基等。
�。
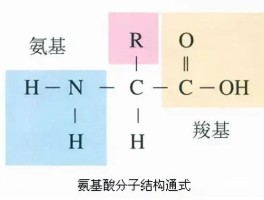
从氨基酸的结构上看,除了侧链R基团不同外,均有α-氨基和α�羧基。
氨基酸在体内的分解代谢实际上就是氨基、羧基和R�基团的代谢。
氨基酸分解代谢的主要途径是脱氨基生成氨ammonia)和相应的α�酮酸;氨基酸的另一条分解途径是脱羧基生成CO2和胺。
胺在体内可经胺氧化酶作用,进一步分解生成氨和相应的醛和酸。
氨对人体来说是有毒的物质,氨在体内主要合成尿素排出体外,还可以合成其它含氮物质(包括非必需氨基酸、谷氨酰胺等),少量的氨可直接经尿排出。
R�基团部分生成的酮酸可进一步氧化分解生成CO2和水,并提供能量,也可经一定的代谢反应转变生成糖或脂在体内贮存。
由于不同的氨基酸结构不同,因此它们的代谢也有各自的特点。
�。
各组织器官在氨基酸代谢上的作用有所不同,其中以肝脏最为重要。
肝脏蛋白质的更新速度比较快,氨基酸代谢活跃,大部分氨基酸在肝脏进行分解代谢,同时氨的解毒过程主要也在肝脏进行。
分枝氨基酸的分解代谢则主要在肌肉组织中进行。
�。
食物中蛋白质的含量也影响氨基酸的代谢速率。高蛋白饮食可诱导合成与氨基酸代谢有关的酶系,从而使代谢加快(图7-1)。
图7-1氨基酸代谢的基本概况
一、氨基酸的脱氨基作用�
图7-2谷氨酸脱氢酶催化的氧化脱氢反应
脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α�酮酸的过程。
这是氨基酸在体内分解的主要方式。
参与人体蛋白质合成的氨基酸共有20种,它们的结构不同,脱氨基的方式也不同,主要有氧化脱氨、转氨、联合脱氨和非氧化脱氨等,以联合脱氨基最为重要。
�。
(一)氧化脱氨基作用(Oxidative
Deamination)�
氧化脱氨基作用是指在酶的催化下氨基酸在氧化脱氢的同时脱去氨基的过程。�。
不需氧脱氢酶催化的氧化脱氨基作用�。
谷氨酸在线粒体中由谷氨酸脱氢酶(glutamate。
dehydrogonase)催化氧化脱氨。
谷氨酸脱氢酶系不需氧脱氢酶,以NAD+或NADP+作为辅酶。
氧化反应通过谷氨酸Cα脱氢转给NAD(P)+形成α�亚氨基戊二酸,再水解生成α�酮戊二酸和氨(图7-2)。
�。
谷氨酸脱氢酶为变构酶。GDP和ADP为变构激活剂,ATP和GTP为变构抑制剂。�。
在体内,谷氨酸脱氢酶催化可逆反应。
一般情况下偏向于谷氨酸的合成(△G°′≈30kJ·mal�1),因为高浓度氨对机体有害,此反应平衡点有助于保持较低的氨浓度。
但当谷氨酸浓度高而NH3浓度低时,则有利于脱氨和α酮戊二酸的生成。
�。
(二)转氨基作用�
转氨基作用(Transamination)指在转氨酶催化下将α-氨基酸的氨基转给另一个α-是酮酸,生成相应的α�酮酸和一种新的α-氨基酸的过程。�。
体内绝大多数氨基酸通过转氨基作用脱氨。
参与蛋白质合成的20种α-氨基酸中,除甘氨酸、赖氨酸、苏氨酸和脯氨酸不参加转氨基作用,其余均可由特异的转氨酶催化参加转氨基作用。
转氨基作用最重要的氨基受体是α�酮戊二酸,产生谷氨酸作为新生成氨基酸:
进一步将谷氨酸中的氨基转给草酰乙酸,生成α�酮戊二酸和天冬氨酸:�。
或转给丙酮酸。生成α�酮戊二酸和丙氨酸,通过第二次转氨反应,再生出α�酮戊二酸。
�
因而体内有较强的谷草转氨酸(glutamic。
pyruvictransaminase,GPT)和谷丙转氨酸(glutamicoxaloacetictransaminase,GOT)活性。�。
转氨基作用是可逆的,该反应中△G°′≈0,所以平衡常数约为1。反应的方向取绝于四种反应物的相对浓度。因而,转氨基作用也是体内某些氨基酸(非必需氨基酸)合成的重要途径。�。
2.转氨基作用机理:�
转氨基作用过程可分为两个阶段:�。
(1)一个氨基酸的氨基转到酶分子上,产生相应的酮酸和氨基化酶:
�
(2)NH2转给另一种酮酸,(如α�酮戊二酸)生成氨基酸,并释放出酶分子:
为传送NH2基因,转氨酶需其含醛基的辅酶-磷酸吡哆醛(pyridoxal-5′-phosphate,PLP)的参与。
在转氨基过程中,辅酶PLP转变为磷酸吡哆胺(pyridoxamine�5′�phosphate,PMP)。
PLP通过其醛基与酶分子中赖氨酸ω氨基缩合形成Schiff碱而共价结合子酶分子中。
�。
EsmondSnell,Alexande
Branstein和DavidMetgler等揭示转氨作用是一种兵乓机制,二阶段各分三步进行(图7-3)。�。
图7-3PLP�依赖的酶促转氨基反应机理。
第一阶段:氨基酸转变为酮酸�。
(1)氨基酸的亲核性NH2基团作用于酶�PLP。
Schiff碱C原子,通过转亚氨基反应(transiminationortrans�Schiffigation)形成一种氨基酸�PLP。
Schiff碱,同时使酶分子中赖氨酸的NH2基团复原。�。
(2)通过酶活性位点赖氨酸催化去除氨基酸α氢,并通过一共振稳定的中间产物在PLP第4位C原子上加质子,将氨基酸桺LP。
Schiff碱分子重排为一个α�酮酸�PMPschiff碱。�。
(3)水解生成PMP和α-酮酸。�。
第二阶段:α�酮酸转变为氨基酸�。
为完成转氨反应循环,辅酶必需由PMP形式转变为E�PLP。
Schiff形式,此过程亦包括三步,为上述反应的逆过程。�。
(1)PMP与一个α�酮酸作用形成α�酮酸�Schiff碱。�。
(2)分子重排,α�酮酸�PMP。
Schiff碱变为氨基酸�PLPSchiff碱。�。
(3)酶活性位点赖氨酸ω�NH2基团攻击氨基酸�PLP。
Schiff碱,通过转亚氨基生成有活性的酶�PLPSchiff碱,并释放出形成的新氨基酸。�。
转氨基反应中,辅酶在PLP和PMP间转换,在反应中起着氨基载体的作用,氨基在α-酮酸和α-�氨基酸之间转移。可见在转氨基反应中并无净NH3的生成。�。
3.转氨基作用的生理意义�
转氨基作用起着十分重要的作用。通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。�。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。�。
(三)联合脱氨基作用�
联合脱氨基作用是体内主要的脱氨方式。主要有两种反应途径:�。
1.由L-谷氨酸脱氢酶和转氨酶联合催化的联合脱氨基作用:先在转氨酶催化下,将某种氨基酸的α-氨基转移到α�酮戊二酸上生成谷氨酸,然后,在L�谷氨酸脱氢酶作用下将谷氨酸氧化脱氨生成α�酮戊二酸,而α�酮戊二酸再继续参加转氨基作用。
�。
L-谷氨酸脱氢酶主要分布于肝、肾、脑等组织中,而α�酮戊二酸参加的转氨基作用普遍存在于各组织中,所以此种联合脱氨主要在肝、肾、脑等组织中进行。
联合脱氨反应是可逆的,因此也可称为联合加氨。
�。
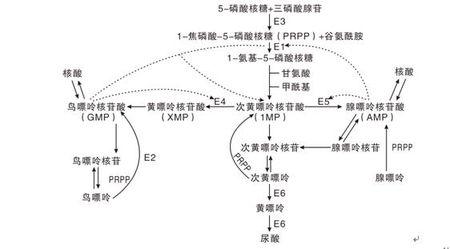
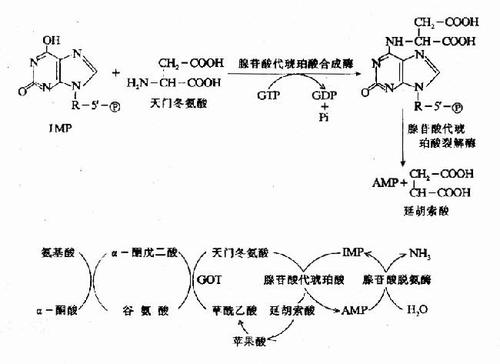
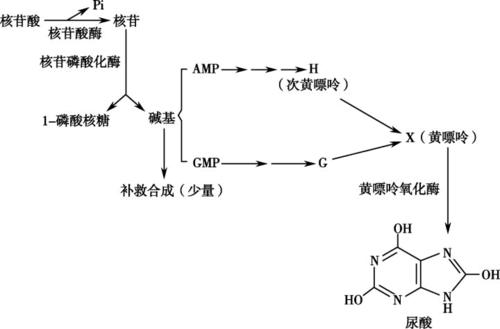
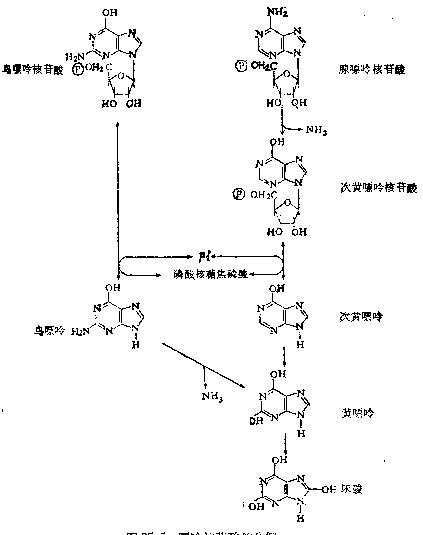
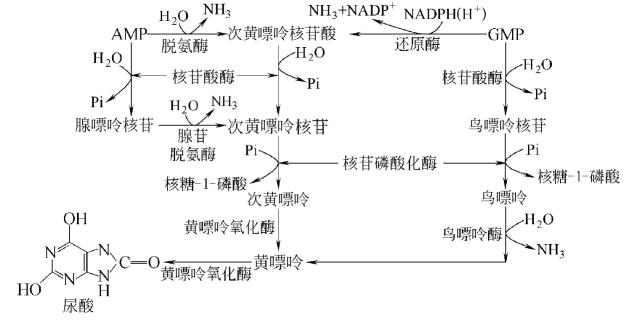
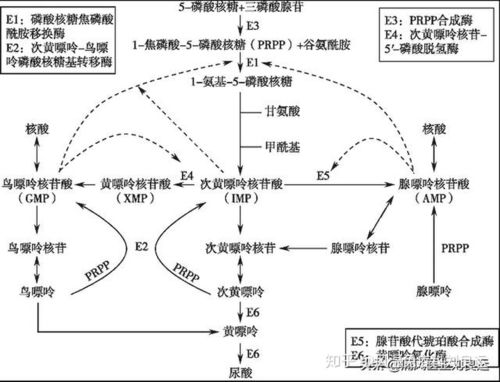
2.嘌呤核苷酸循环(purine
nucleotidecycle):骨骼肌和心肌组织中L�谷氨酸脱氢酶的活性很低,因而不能通过上述形式的联合脱氨反应脱氨。但骨骼肌和心肌中含丰富的腺苷酸脱氨酶(adenylate。
deaminase),能催化腺苷酸加水、脱氨生成次黄嘌呤核苷酸(IMP)。�。
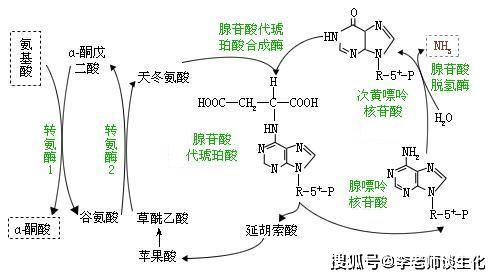
一种氨基酸经过两次转氨作用可将α-氨基转移至草酰乙酸生成门冬氨酸。门冬氨酸又可将此氨基转移到次黄嘌呤核苷酸上生成腺嘌呤核苷酸(通过中间化合物腺苷酸代琥珀酸)。其脱氨过程可用图7-4表示。
图7-4腺嘌呤核苷酸循环
目前认为嘌呤核苷酸循环是骨骼肌和心肌中氨基酸脱氨的主要方式。John。
lowenstein证明此嘌呤核苷酸循环在肌肉组织代谢中具有重要作用。
肌肉活动增加时需要三羧酸循环增强以供能。
而此过程需三羧酸循环中间产物增加,肌肉组织中缺乏能催化这种补偿反应的酶。
肌肉组织则依赖此嘌呤核苷酸循环补充中间产物-草酰乙酸。
研究表明肌肉组织中催化嘌呤核苷酸循环反应的三种酶的活性均比其它组织中高几倍。
AMP脱氨酶遗传缺陷患者(肌腺嘌呤脱氨酶缺乏症)易疲劳,而且运运后常出现痛性痉挛。
这种形式的联合脱氨是不可逆的,因而不能通过其逆过程合成非必需氨基酸。这一代谢途径不仅把氨基酸代谢与糖代谢、脂代谢联系起来,而且也把氨基酸代谢与核苷酸代谢联系起来。�。
(四)非氧化脱氨基作用(non�oxidative。
deamination)�
某些氨基酸还可以通过非氧化脱氨基作用将氨基脱掉。�。
1.脱水脱氨基如丝氨酸可在丝氨酸脱水酶的催化下生成氨和丙酮酸。
苏氨酸在苏氨酸脱水酶的作用下,生成α-酮丁酸,再经丙酰辅酶A,琥珀酰AoC参加代谢,如下图所示。
这是苏氨酸在体内分解的途径之一。�。
2.脱硫化氢脱氨基半胱氨酸可在脱硫化氢酶的催化下生成丙酮酸和氨。
�
3.直接脱氨基天冬氨酸可在天冬氨酸酶作用下直接脱氨生成延胡索酸和氨。�。
二、氨的代谢�
(一)氨的来源�
1.组织中氨基酸分解生成的氨组织中的氨基酸经过联合脱氨作用脱氨或经其它方式脱氨,这是组织中氨的主要来源。
组织中氨基酸经脱羧基反应生成胺,再经单胺氧化酶或二胺氧化酶作用生成游离氨和相应的醛,这是组织中氨的次要来源,组织中氨基酸分解生成的氨是体内氨的主要来源。
膳食中蛋白质过多时,这一部分氨的生成量也增多。
�。
2.肾脏来源的氨血液中的谷氨酰胺流经肾脏时,可被肾小管上皮细胞中的谷氨酰胺酶(glutaminase)分解生成谷氨酸和NH3。
这一部分NH3约占肾脏产氨量的60%。其它各种氨基酸在肾小管上皮细胞中分解也产生氨,约占肾脏产氨量的40%。�。
肾小管上皮细胞中的氨有两条去路:排入原尿中,随尿液排出体外;或者被重吸收入血成为血氨。
氨容易透过生物膜,而NH+4不易透过生物膜。
所以肾脏产氨的去路决定于血液与原尿的相对pH值。
血液的pH值是恒定的,因此实际上决定于原尿的pH值。
原尿pH值偏酸时,排入原尿中的NH3与H+结合成为NH+4,随尿排出体外。
若原尿的pH值较高,则NH3易被重吸收入血。
临床上血氨增高的病人使用利尿剂时,应注意这一点。
�。
3.肠道来源的氨这是血氨的主要来源。
正常情况下肝脏合成的尿素有15?0%经肠粘膜分泌入肠腔。
肠道细菌有尿素酶,可将尿素水解成为CO2和NH3,这一部分氨约占肠道产氨总量的90%(成人每日约为4克)。
肠道中的氨可被吸收入血,其中3/4的吸收部位在结肠,其余部分在空肠和回肠。
氨入血后可经门脉入肝,重新合成尿素。
这个过程称为尿素的肠肝循环(entero�hepatin。
circulationofurea)。�。
肠道中的一小部分氨来自腐败作用(putrescence)。
这是指未被消化吸收的食物蛋白质或其水解产物氨基酸在肠道细菌作用下分解的过程。
腐败作用的产物有胺、氨、酚、吲哚、H2S等对人体有害的物质,也能产生对人体有益的物质,如脂肪酸、维生素K、生物素等。
�。
肠道中NH3重吸收入血的程度决定于肠道内容物的pH值,肠道内pH值低于6时,肠道内氨生成NH+4,随粪便排出体外;肠道内pH值高于6时,肠道内氨吸收入血。
临床上给高血氨病人作灌肠治疗时,禁忌使用肥皂水等,以免加重病情。
�。
(二)氨的去路�
氨是有毒的物质,人体必须及时将氨转变成无毒或毒性小的物质,然后排出体外。
主要去路是在肝脏合成尿素、随尿排出;一部分氨可以合成谷氨酰胺和门冬酰胺,也可合成其它非必需氨基酸;少量的氨可直接经尿排出体外。
尿中排氨有利于排酸。
�。
图7-5氨的来源和去路
(三)氨的转运�
1.葡萄糖-丙氨酸循环:肌肉组织中以丙酮酸作为转移的氨基受体,生成丙酸经血液运输到肝脏。
在肝脏中,经转氨基作用生成丙酮酸,可经糖异生作用生成葡萄糖,葡萄糖由血液运输到肌肉组织中,分解代谢再产生丙酮酸,后者再接受氨基生成丙氨酸。
这一循环途径称为“丙氨酸椘咸烟茄�贰?alanine�glucose。
cycle)。通过此途径,肌肉氨基酸的NH2基,运输到脏脏以NH3或天冬氨酸合成尿素。(图7-6)�。
图7-6葡萄糖�丙氨酸循环
饥饿时通过此循环将肌肉组织中氨基酸分解生成的氨及葡萄糖的不完全分解产物丙酮酸,以无毒性的丙氨酸形式转运到肝脏作为糖异生的原料。肝脏异性生成的葡萄糖可被肌肉或其它外周组织利用。�。
2.氨与谷氨酸在谷氨酰胺合成酶(glutamine。
synthetase)的催化下生成谷氨酰胺(glutamine),并由血液运输至肝或肾,再经谷氨酰酶(glutaminaes)水解成谷氨酸和氨。谷氨酰胺主要从脑、肌肉等组织向肝或肾运氨。
���。
(四)尿素合成�
根据动物实验,人们很早就确定了肝脏是尿素合成的主要器官,肾脏是尿素排泄的主要器官。
1932年Krebs等人利用大鼠肝切片作体外实验,发现在供能的条件下,可由CO2和氨合成尿素。
若在反应体系中加入少量的精氨酸、鸟氨酸或瓜氨酸可加速尿素的合成,而这种氨基酸的含量并不减少。
为此,Krebs等人提出了鸟氨酸循环(ornithine。
cyclc)学说。其后由Ratner和Cohen详细论述了其各步反应。鸟氨酸循环可概括为:�。
尿素中的两个N原子分别由氨和天冬氨酸提供,而C原子来自HCO-3,五步酶促反应,二步在线粒体中,三步在胞液中进行。其详细过程可分为以下五步:�。
图7-7CPS�Ⅰ作用机理
1.氨基甲酰磷酸的合成�
氨基甲酰磷酸(carbamyl
phosphate)是在Mg++、ATP及N�乙酰谷氨酸(N�acetylglutamic。
acid,AGA)存在的情况下,由氨基甲酰磷酸合成酶I(carbamylphosphate。
synthetaseI,CPS�I)催化NH3和HCO-3在肝细胞线粒体中合成。
真核细胞中有两种CPS:(1)线粒体CPS�-Ⅰ利用游离NH3为氮源合成氨基甲酰磷酸,参与尿素合成。(2)胞液CPS-Ⅱ,利用谷氨酰胺作N源,参与嘧啶的从头合成。�。
CPS-Ⅰ催化的反应包括下述三步(图7-7)。�。
(1)ATP活化HCO-3生成ADP和羰基硫酸(carbonyl。
phosphate)�
(2)NH2与羰基硫酸作用替代硫酸根,生成氨基甲酸(carbamate)和Pi。�。
(3)第2个ATP对氨甲酸磷酸化,生成氨基甲酰磷酸和ADP。�。
此反应是不可逆的,消耗2分子ATP。CPS�1是一种变构酶,AGA是此酶变构激活剂。由乙酰CoA和谷氨酸缩合而成。�。
肝细胞线粒体中谷氨酸脱氢酶和氨基甲酰磷酸合成酶I催化的反应是紧密偶联的。
谷氨酸脱氢酶催化谷氨酸氧化脱氨,生成的产物有NH3和NADH+H+。
NADH经NADH氧化呼吸链传递氧化生成H2O,释放出来的能量用于ADP磷酸化生成ATP。
因此谷氨酸脱氢酶催化反应不仅为氨基甲酰磷酸的合成提供了底物NH3,同时也提供了该反应所需要的能量ATP。
氨基甲酰磷酸合成酶I将有毒的氨转变成氨基甲酰磷酸,反应中生成的ADP又是谷氨酸脱氢酶的变构激活剂,促进谷氨酸进一步氧化脱氨。
这种紧密偶联有利于迅速将氨固定在肝细胞线粒体内,防止氨逸出线粒体进入细胞浆,进而透过细胞膜进入血液,引起血氨升高。
�。
2.瓜氨酸(citrulline)的生成:�。
乌氨酸氨基甲酰转移酶(ornithinetranscarbamoylase)存在于线粒体中,通常与CPS-I形成酶的复合物催化氨基甲酰磷酸转甲酰基给鸟氨酸生成瓜氨酸。
(注意:鸟氨酸,瓜氨酸均非标准α-氨基酸,不出现在蛋白质中)。
此反应在线粒体内进行,而鸟氨酸在胞液中生成,所以必需通过一特异的穿棱系统进入线粒体内。
�
3.精氨酸代琥珀酸(Argininosuccinate)的合成。�。
瓜氨酸穿过线粒体膜进入胞浆中,在胞浆中由精氨酸代琥珀酸合成酶(Argininosuccinate。
Synthetase)催化瓜氨酸的脲基与天冬氨酸的氨基缩合生成精氨酸代琥珀酸,获得尿素分子中的第二个氮原子。此反应由ATP供能。�。
4.精氨酸(Arginine)的生成�。
精氨酸代琥珀酸裂解酶(Argininosuccinase)催化精氨酸代琥珀酸裂解成精氨酸和延胡索酸。
上述反应中生成的延胡索酸可经三羧酸循环的中间步骤生成草酰乙酸,再经谷草转氨酶催化转氨作用重新生成天冬氨酸。由此,通过延胡索酸和天冬氨酸,使三羧酸循环与尿素循环联系起来。�。
5.尿素的生成�
尿素循环的最后一步反应是由精氨酸酶(arginase)催化精氨酸水解生成尿素并再生鸟氨酸,鸟氨酸再进入线粒体参与另一轮循环。�。
尿素合成是一个耗能的过程,合成1分子尿素需要消耗4个高能磷酸键。
(3个ATP水解生成2个ADP,2个Pi,1个AMP和PPi)。
从尿素循环底物水平上,能量的消耗大于恢复。
由L-谷氨酸脱氢酶催化脱氨和延胡索酸经草酰乙酸再生成天冬氨酸反应中均有NADH的生成。
经线粒体再氧化可生成6个ATP(图7-8)。
�。
图7-8尿素循环的能量代谢
6.尿素循环的调节�
CPS-I是线粒体内变构酶,其变构激活剂AGA由N�乙酰谷氨酸合成酶催化生成,并由特异水解酶水解。
肝脏生成尿素的速度与AGA浓度相关。
当氨基酸分解旺盛时,由转氨作用引起谷氨酸浓度升高,增加AGA的合成,从而激活CPS-I,加速氨基甲酰磷酸合成,推动尿素循环。
精氨酸是AGA合成酶的激活剂,因此,临床利用精氨酸治疗高氨血症。
�。
(五)高氨血症和氨中毒�
正常生理情况下,血氨处于较低水平。
尿素循环是维持血氨低浓度的关键。
当肝功能严重损伤时,尿素循环发生障碍,血氨浓度升高,称为高氨血症。
氨中毒机制尚不清楚。
一般认为,氨进入脑组织,可与α酮戊二酸结合成谷氨酸,谷氨酸又与氨进一步结合生成谷氨酰胺,从而使α�酮戊二酸和谷氨酸减少,导致三羧酸循环减弱,从而使脑组织中ATP生成减少。
谷氨酸本身为神经递质,且是另一种神经递质γ-氨基丁酸(γ-aminobutyrate,GABA)的前体,其减少亦会影响大脑的正常生理功能,严重时可出现昏迷。
�。
二、α�酮酸的代谢�。
氨基酸经联合脱氨或其它方式脱氨所生成的α-酮酸有下述去路。�。
1.生成非必需氨基酸-α-酮酸经联合加氨反应可生成相应的氨基酸。
八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相应的α-酮酸加氨生成。
但和必需氨基酸相对应的α-酮酸不能在体内合成,所以必需氨基酸依赖于食物供应。
�。
2.氧化生成CO2和水
这是α-酮酸的重要去路之一。
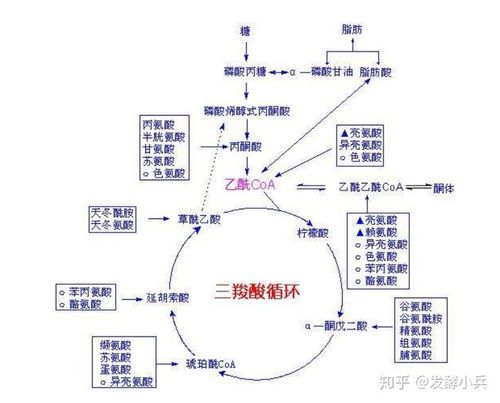
由图7?可以看出α�酮酸通过一定的反应途径先转变成丙酮酸、乙酰CoA、或三羧酸循环的中间产物,再经过三羧酸循环彻底氧化分解。
三羧酸循环将氨基酸代谢与糖代谢、脂肪代谢紧密联系起来。
�
图7-9氨基酸与糖、脂肪的关系
3.转变生成糖和酮体使用四氧嘧啶(alloxan)破坏犬的胰岛β�细胞,建立人工糖尿病犬的模型。
待其体内糖原和脂肪耗尽后,用某种氨基酸饲养,并检查犬尿中糖与酮体的含量。
若饲某种氨基酸后尿中排出葡萄糖增多,称此氨基酸为称生糖氨基酸(glucogenic。
aminoacid);若尿中酮体含量增多,则称为生酮氨基酸(ketogenic。
aminoacid)。尿中二者都增多者称为生糖兼生酮氨基酸(glucogenic。
andketogenicaminoacid)。
从表7-1中可以看出,凡能生成丙酮酸或三羧酸循环的中间产物的氨基酸均为生糖氨基酸;凡能生成乙酰CoA或乙酰乙酸的氨基酸均为生酮氨基酸;凡能生成丙酮酸或三羧酸循环中间产物同时能生成乙酰CoA或乙酰乙酸者为生糖兼生酮氨基酸。
�。
表7-1氨基酸和糖、脂肪的共有中间代谢产物。
氨基酸简称
共同中间代谢产物
生糖或生酮
天
草酰乙酸
生糖
丝、甘、丙、羟、脯、半胱、胱、
丙酮酸
生糖
苏
丙酮酸、琥珀酰辅酶A
生糖
色
丙酮酸、乙酰乙酸
生糖兼生酮
谷、组、鸟、精、瓜、脯
α-酮戊二酸
生糖
蛋、缬
琥珀酰辅酶A
生糖
异亮
琥珀酰辅酶A、乙酰辅酶A
生糖兼生酮
酪、苯丙
乙酰乙酸、延胡索酸
生糖兼生酮
亮
乙酰乙酸
生酮
赖
乙酰辅酶A、α-酮戊二酸(?)
生糖兼生酮
亮氨酸为生酮氨基酸,赖氨酸、异亮氨酸、色氨酸、苯丙氨酸和酪氨酸为生糖兼生酮氨基酸,其余氨基酸均为生糖氨基酸。�。
四、脱羧基作用�
部分氨基酸可在氨基酸脱羧酶(decarboxylose)催化下进行脱羧基作用(decarboxylation),生成相应的胺,脱羧酶的辅酶为磷酸吡哆醛。�。
从量上讲,脱羧基作用不是体内氨基酸分解主要方式,但可生成有重要生理功能的胺。下面列举几种氨基酸脱羧产生的重要胺类物质。�。
1.γ�氨基丁酸(γ�aminobutyric。
acidGABA)�
GABA由谷氨酸脱羧基生成,催化此反应的酶是谷氨酸脱羧酶。此酶在脑、肾组织中活性很高,所以脑中GABA含量较高。
GABA是一种仅见于中枢神经系统的抑制性神经递质,对中枢神经元有普遍性抑制作用。在脊髓,作用于突触前神经末梢,减少兴奋性递质的释放,从而引起突触前抑制,在脑则引起突触后抑制。�。
GABA可在GABA转氨酶(GABA-T)作有下与α-酮戊二酸反应生成琥珀酸r-半醛(succinic。
acidsemialdehyde),进而氧化生成琥珀酸。����。
��
神经元胞体和突触的线粒体内含有大量的GABA转氨酶。
由此就构成了GABA旁路(图7-10)。
它能使α�酮戊二酸经此旁路生成琥珀酸,活跃三羧酸循环,可为脑组织提供约20%的能量。
谷氨酸具有兴奋作用,GABA有抑制作用,两者可共同调节神经系统的功能。
临床上对于惊厥和妊娠呕吐的病人常常使用维生素B6治疗,其机理就在于提高脑组织内谷氨酸脱羧酶的活性,使GABA生成增多,增强中枢抑制作用。
��。
图7-10脑中TCA循环和GAB代谢旁路
2.组胺(histamine)�。
由组氨酸脱羧生成。组胺主要由肥大细胞产生并贮存,在乳腺、肺、肝、肌肉及胃粘膜中含量较高。�。
组胺是一种强烈的血管舒张剂,并能增加毛细血管的通透性。可引起血压下降和局部水肿。组胺的释放与过敏反应症状密切相关。组胺可刺激胃蛋白酶和胃酸的分泌,所以常用它作胃分泌功能的研究。�。
3.5羟色胺(5�hydroxytryptamine,5�HT)�。
色氨酸在脑中首先由色氨酸羟化酶(tryoptophan。
hydroxylase)催化生成5羟色氨酸(5�hydroxy�tryptophan),再经脱羧酶作用生成5羟色胺。�。
5-羟色胺在神经组织中有重要的功能,目前已肯定中枢神经系统有5-羟色胺能神经元。5-羟色胺可使大部分交感神经节前神经元兴奋,而使付交感节前神经元抑制。�。
其它组织如小肠、血小板、乳腺细胞中也有5-羟色胺,具有强烈的血管收缩作用。�。
4.牛磺酸(taurine)�。
体内牛磺酸主要由半胱氨酸脱羧生成。半胱氨酸先氧化生成磺酸丙氨酸,再由磺酸丙氨酸脱羧酶催化脱去羧基,生成牛磺酸。牛磺酸是结合胆汁酸的重要组成分。�。
���。
5.多胺(palyamine)�。
鸟氨酸在鸟氨酸脱羧酶催化下可生成腐胺(putrescine),S-腺苷蛋氨酸(S-adenosyl。
methionineSAM)在SAM脱羧酶催化脱羧生成S-腺苷-3-甲硫基丙胺。
在精脒合成酶(spormidinesynthetase)催化下将S-腺苷-3-甲硫基丙胺的丙基移到腐胺分子上合成精脒(cpermidine),再在精胺合成酶(spermine。
symthetase)催化下,再将另一分子S-腺苷-3-甲硫基丙胺的丙胺基转移到精脒分子上,最终合成了精胺(sperrmine)。腐胺、精脒和精胺总称为多胺或聚胺polyamine)(图7-11)。
图7-11多胺的生成
多胺存在于精液及细胞核糖体中,是调节细胞生长的重要物质,多胺分子带有较多正电荷,能与带负电荷的DNA及RNA结合,稳定其结构,促进核酸及蛋白质合成的某些环节。
在生长旺盛的组织如胚胎、再生肝及癌组织中,多胺含量升高。
所以可将利用血或尿中多胺含量作为肿瘤诊断的辅助指标。










还没有评论,来说两句吧...