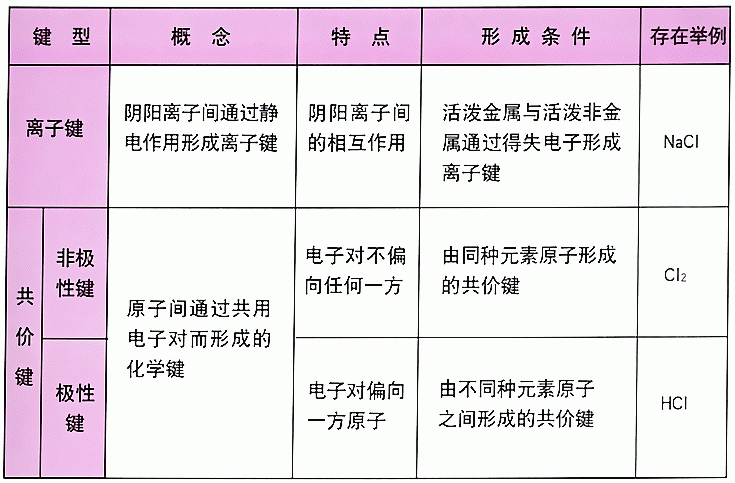
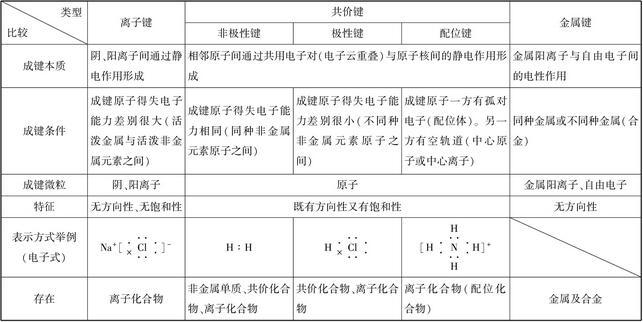
可以通过以下三个不同点进行区分:
1、形成过程不同:离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的,共价键是原子间通过共用电子对而形成的,原子间没有得失电子,形成的化合物中不存在阴阳离子。
2、成键时方向性不同:离子键在成键时没有方向性,而共价键却有方向性。离子键是阴阳离子间通过静电引力形成的化学键,一个离子在任何方向都能同样吸引带相反电荷的离子,因此离子键没有方向性。
而共价键却大不相同,共价键的形成是成键原子的电子云发生重叠,如果电子云重叠程度越多,两核间电子云密度越大,形成的共价键就越牢固。
3、性质不同:共价键是化学键的一种,两个或多个原子共同使用外层电子,在理想情况下达到电子饱和的状态,离子键是化学键的一种,通过两个或多个原子失去或获得电子而成为离子后形成。
此类化学键往往在金属与非金属间形成。
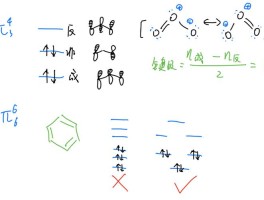
重叠的形式
电子云理论将共价键形成化作了重叠的形式,分为σ键与π键的形式。
σ键是s轨道两个原子核相互靠近类似于头碰头的形式。π键是p轨道肩碰肩的方式靠近形成的共价键。
σ键与π键相比,π键更容易断裂,所以导致乙烯(CH₂CH₂)和乙烷(CH₃CH₃)的性质并不太一致。
离子键
离子键:
定义
:使相邻的阴、阳离子结合成化合物的静电作用。
形成原因:
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如
Na+、K+
;也可以由原子团形成,如
Cl-
,NO3-
等
含有离子键的物质(高中要求记住的)
1
活泼金属阳离子
和
活泼非金属阴离子
形成的盐类
例如(
KCl
CsSO4
KNO3
Na2S
等
)
2
所有铵盐
例如(
NH4Cl
NH4SO4
)
3
低价金属氧化物
(注意
必须是低价
1或2价
)
例如(
Na2O
K2O
CaO
)
4
强碱
(弱碱有些并不是)
例如(
NaOH
KOH
)
5
过氧化物
超氧化物
碳化钙
(CaC2
电石)
例如(
Na2O2
CaO2
KO2
BaO4
)
注意
:
含有离子键的化合物
一定是
离子化合物
!!
共价键
定义:
共价键的形成是相邻两个原子之间自旋方向相反的电子相互配对,此时原子轨道相互重叠,两核间的电子云密度相对地增大,从而增加对两核的引力。
共价键的作用力很强,有饱和性与方向性。
因为只有自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外,原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。
共价键又可分为三种:
(1)非极性共价键
形成共价键的电子云正好位于键合的两个原子正中间,如金刚石的C—C键。
(2)极性共价键
形成共价键的电子云偏于对电子引力较大的一个原子,如Pb—S。
键,电子云偏于S一侧,可表示为Pb→S。
(3)配价键
共享的电子对只有一个原子单独提供。如Zn—S键,共享的电子对由锌提供,(这个高中不必学)。
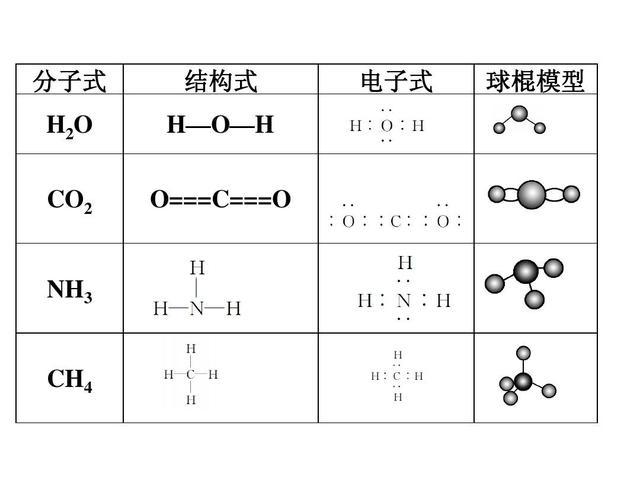
共价化合物
:
1
非金属之间形成的化合物(除铵盐)
2
少数盐类
(
AlCl3
和
FeCl3
)
3
所有酸类
区别离子化合物和共价化合物
看溶于水(或其它溶剂)是否导电
高中阶段记住这些
已经足够
现在
我教你怎么区分
(最快的方法)
一般来说在高中阶段
只要你在题目中看到的化合物含有
第一主族的金属
(碱金属)
那么一定是离子键
只要你看到题目所给的化合物没有金属元素
那么是共价键
(除了铵盐)
一定要背好各种离子的化学式









还没有评论,来说两句吧...