能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)。
(2)苯酚等酚类物质(取代)
(3)含醛基物质(氧化)
(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)。
(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)。
(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。)。
溴水:
溴单质与水的混合物。
溴单质可溶于水,80%以上的溴会与水反应生成氢溴酸与次溴酸,但仍然会有少量溴单质溶解在水中,所以溴水呈橙黄色。
新制溴水可以看成是溴的水溶液,进行与溴单质有关的化学反应,但时间较长的溴水中溴分子也会分解,溴水逐渐褪色。
久置的溴水中只含有氢溴酸。
次溴酸会在光照下分解成氢溴酸和氧气。
化学反应
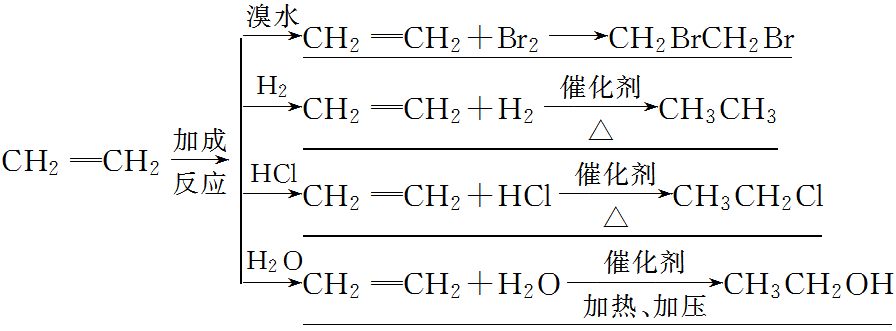
①烯烃、炔烃、二烯烃等不饱和烃类反应(加成反应)。
CH2=CH2+Br2--→CH2Br-CH2Br。
CH≡CH+Br2--→CHBr=CHBr。
(或CH≡CH+2Br2--→CHBr2-CHBr2。
CH2=CH-CH=CH2+Br2--→CH2Br-CH=CH-CH2Br。
(或CH2=CH-CH=CH2+Br2--→CH2Br-CHBr-CH=CH2)。
②与苯酚,苯胺反应生成白色沉淀(过量的浓溴水与苯酚得2,4,6即邻对位的取代产物,高中常考苯环上的取代位置的迁移应用哦。)。
③与醛类等有醛基的物质反应
与醛的反应比较复杂,涉及同时发生的两类反应(一般是取代反应为主)。
一是对于醛α-氢的溴代如CH3CHO+Br2=BrCH2CHO+HBr,反应最终可以生成三溴乙醛,碱性条件可以生成溴仿(三溴甲烷);。
二是溴单质对于醛基的氧化CH3CHO+Br2+H2O=CH3COOH+2HBr,并且实际上是取代反应为主的,因为这实际上是工业制备三溴乙醛的方法(溴与乙醇反应,生成醛之后进一步取代),这可以说明对醛基的氧化实际上是次要的。
④与具有α-氢的酮的取代反应,如CH3COCH3+Br2=BrCH2COCH3+HBr,取代可以一直进行,甲基酮在碱性条件可以生成溴仿,这与醛的反应类似。
(比较:纯净的溴单质和烷烃在光照条件下可以发生取代反应。
)。
⑤对于伯仲醇的氧化反应,溴水可以比较慢的把伯仲醇氧化生成醛,酮并进一步发生上面提到的两类反应。
(注:伯醇:与羟基相连的碳原子上有2个氢为伯醇,结构简式为R-CH2-OH。
仲醇是羟基(-OH)所在碳(即羟基碳)连有两个碳(或取代基)的醇,即R1-CH(R2)-OH。
叔醇:羟基所在位置有三个取代基的醇,即R1-C(R2)(R3)-OH,(没有α-H的醇)叔醇不能被溴水氧化。
仲醇被氧化可生成酮,但不能生成醛。
)[1]。
⑥与环丙烷及其衍生物的开环加成:环丙烷及其衍生物可以与溴水发生开环加成反应,这与高锰酸钾联用可以检验三元碳环,因为环丙烷室温下不能与高锰酸钾反应。
⑦与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应。
在0℃时:Br2+2NaOH=NaBr+NaBrO+H2O(常温下:3Br2+6NaOH=5NaBr+NaBrO3+3H2O)。
3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2。
⑧与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应。
Br2+H2S=2HBr+S↓(浅黄色沉淀)。
Br2+SO2+2H2O=2HBr+H2SO4。
3Br2+6FeSO4=2Fe2(SO4)3+2FeBr3。
Br2+2KI=2KBr+I2(溶液变为棕色)
ch2chcooch3与溴水反应
①烯烃、炔烃、二烯烃等不饱和烃类反应。
CH2=CH2+Br2——→CH2Br-CH2Br。
CH≡CH+Br2——→CHBr=CHBr(或CH≡CH+2Br2——→CHBr2-CHBr2)。
CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)。
②与苯酚,苯胺反应生成白色沉淀
③与醛类等有醛基的物质反应
与醛的反应比较复杂,涉及同时发生的两类反应(一般是取代反应为主)。
一是对于醛阿尔法氢的溴代如CH3CHO+Br2=BrCH2CHO+HBr,反应最终可以生成三溴乙醛,碱性条件可以生成溴仿。
二是Br2对于醛基的氧化CH3CHO+Br2+H2O=CH3COOH+2HBr,并且实际上是取代反应为主的,因为这实际上是工业制备三溴乙醛的方法(溴与乙醇反应,生成醛之后进一步取代),这可以说明对醛基的氧化实际上是次要的。
④与具有阿尔法氢的酮的取代反应,如CH3COCH3+Br2=BrCH2COCH3+HBr,取代可以一直进行,甲基酮在碱性条件可以生成溴仿,这与醛的反应类似
还有与环丙烷及其衍生物的开环加成
⑤对于伯仲醇的氧化反应,溴水可以比较慢的把伯仲醇氧化生成醛,酮并进一步发生上面提到的两类反应。
⑥环丙烷及其衍生物可以与溴水发生开环加成反应,这与高锰酸钾联用可以检验三元碳环,因为环丙稀室温下不能与高锰酸钾反应。
⑦与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应。
Br2+2NaOH=NaBr+NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)Br2+Na2CO3=NaBr+NaBrO+CO2。
⑧与较强的无机还原剂(如H2S、SO2、KI和FeSO4等)发生反应。
Br2+H2S=2HBr+S↓(浅黄色沉淀)。
Br2+SO2+2H2O=2HBr+H2SO4。
3Br2+6FeSO4=2Fe2(SO4)3+2FeBr3。
Br2+2KI=2KBr+I2(溶液变为棕色)。
⑨与苯、甲苯、四氯化碳等有机溶液混合振荡,因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。
检验溴水的反应
物理褪色—萃取
与水相比,溴单质易溶于四氯化碳、苯、汽油等有机溶剂,当在溴水中加入难溶于水的有机溶剂时,溴水中的溴进入有机溶剂而使溴水的橙色褪去,有机溶剂层因溶有溴而呈橙红色。
化学褪色
溴的化学性质(尤其是氧化性)比较活泼,能与许多物质因反应而褪色。
(1)、遇强碱溶液褪色
如:向溴水中加入NaOH溶液,溴水的橙色褪去。
Br2+2NaOH=NaBr+NaBrO+H2O。
(2)、遇某些盐溶液褪色
如:向溴水中加入Na2CO3或AgNO3溶液可使溴水的橙色褪色。
Br2+H2O=HBr+HBrO
2HBr+Na2CO3=2NaBr+H2O+CO2↑。
HBr+AgNO3=AgBr↓+HNO3
(3)、遇某些还原剂褪色
溴水中的溴具有较强的氧化性,遇某些还原剂会因氧化还原反应而使溴水的橙色褪去。如向溴水中通入H2S、SO2,或加入镁粉、锌粉、铁粉等都可使溴水褪色。
Br2+H2S=2HBr+S↓
Br2+SO2+2H2O=2HBr+H2SO4。
Br2+Mg=MgBr2
Br2+Zn=ZnBr2
3Br2+2Fe=2FeBr3
(4)、与不饱和化合物的加成褪色
CH2=CH2+Br2=CH2BrCH2Br。
CH2=CH-COOH+Br2=CH2BrCHBrCOOH。
(5)、与有机化合物的取代褪色
另外,溴水还可与酸性高锰酸钾溶液一起检验苯的同系物,即苯的同系物可使酸性高锰酸钾溶液褪色,也能使溴水褪色,而苯不能使酸性高锰酸钾溶液褪色也不能使溴水褪色











还没有评论,来说两句吧...