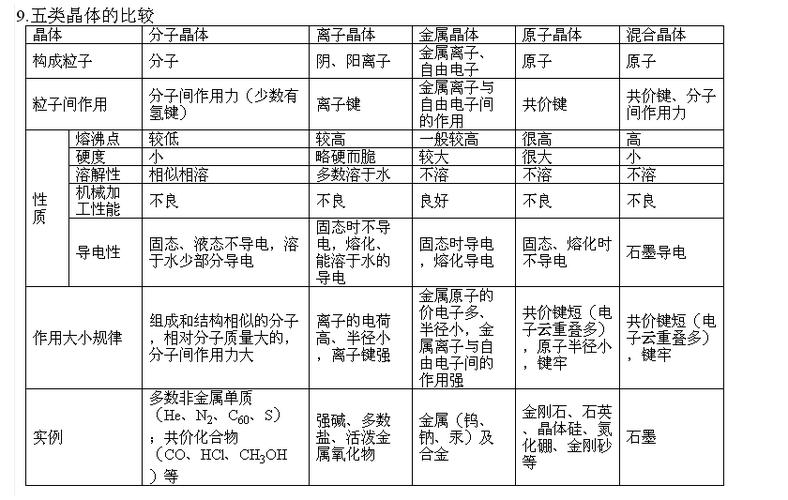
化学键或分子间作用力强弱决定熔沸点高低。
一般:原子晶体>离子晶体>分子晶体,金属晶体的熔沸点变化很大(如钨、汞)。
对于原子晶体,成键原子半径越小,键长越短,键能越大,共价键越强,原子晶体的熔沸点越高。
对于离子晶体,离子电荷数大小(主要因素)和离子半径的大小决定离子键的强弱决定熔沸点的高低。一般地,离子键随着离子电荷数的增大、离子半径的减小儿增强。
对于分子晶体,范德华力越强,熔沸点越高。
(1.组成和结构相似的分子,一般相对分子质量越大,分子间作用里越强,分子晶体的熔沸点越高。
2.对于相对质量相同的分子,如同分异构体,一般地,支链数越多,沸点越低,分子越对称,则熔点越高。注意:并非外界条件对物质熔沸点的影响总是一致的。熔点常与晶体空间结构的对称性有关。
3.若分子间有氢键,则分子间作用力比结构相似的其他同类晶体强,故熔沸点相对高)。
对于金属晶体,离子电荷数大小(主要因素)和离子半径大小决定金属键的强弱决定熔沸点高低。一般地,金属键随着金属阳离子电荷数的增大、离子半径电减小而增强
范德华力和熔点的关系
问题一:单质熔点与什么因素有关?单质的熔沸点与单质分子间的作用力大小有关.
比如:
碱金属单质的原子以金属键作用,原子序数增大时,原子半径增大,金属键的键长变大,破坏金属键所需的能量减小,所以熔沸点依次降低.
卤素单质是以分子形态出现的,相互间的作用力为范德华力(就是分子间的作用力),原子序数增大时,分子量也增大,分子间的作用力就增大,所以熔沸点逐渐升高.
问题二:熔沸点与什么有关1、对于晶体类型不同的物质,一般来讲:原子晶体>离子晶体>分子晶体,而金属晶体的熔点范围很广。
2、原子晶体:原子晶体原子间键长越短、键能越大,共价键越稳定,物质熔沸点越高,反之越低。如:
金刚石(C―C)>碳化硅(Si―C)>晶体硅(Si―Si)。
3、离子晶体:离子晶体中阴、阳离子半径越小,电荷数越高,则离子键越强,熔沸点越高,反之越低。
如KF>KCl>KBr>KI,CaO>KCl。
4、金属晶体:金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子静电作用越。
强,金属键越强,熔沸点越高,反之越低。如:Na<Mg<Al。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。
5、分子晶体:分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点。
反常地高)如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3OCH3。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH4<SiH4<GeH4<SnH4。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高,如熔沸点。
CO>N2,CH3OH>CH3CH3。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。如:
C17H35COOH>C17H33COOH;
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。
如:CH3(CH2)3CH3(正)>CH3CH2CH(CH3)2(异)>(CH3)4C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低。
(沸点按邻、间、对位降低。
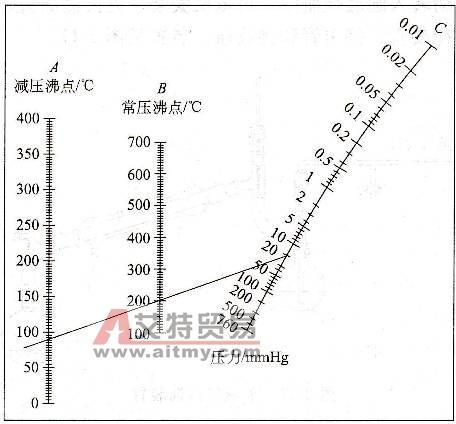
问题三:熔点与大气压有关吗?受影响的・・・但与沸点不同的是,熔点受压力的影响很小~。
熔点是一种物质的一个物理性质.物质的熔点并不是固定不变的,有两个因素对熔点影响很大.一是压强,另一个就是物质中的杂质.平时所说的物质的熔点,通常是指一个大气压时的情况;如果压强变化,熔点也要发生变化.熔点随压强的变化有两种不同的情况.对于大多数物质,熔化过程是体积变大的过程,当压强增大时,这些物质的熔点要升高;对于像水这样的物质,与大多数物质不同,冰熔化成水的过程体积要缩小(金属铋、锑等也是如此),当压强增大时冰的熔点要降低.









还没有评论,来说两句吧...