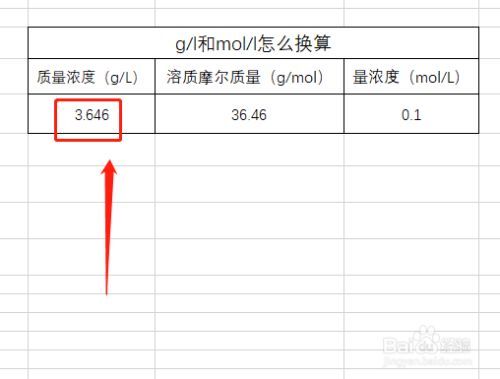
具体换算方法如下:
1、1摩尔(mol)=1000毫摩尔(mmol)。
2、1毫摩尔(mmol)=1000微摩尔(μmol)。
3、1微摩尔(μmol)=1000纳摩尔(nmol)。
4、1纳摩尔(nmol)=1000皮摩尔(pmol)。
5、11mmol/L=1000μmol/L=1000000nmol。
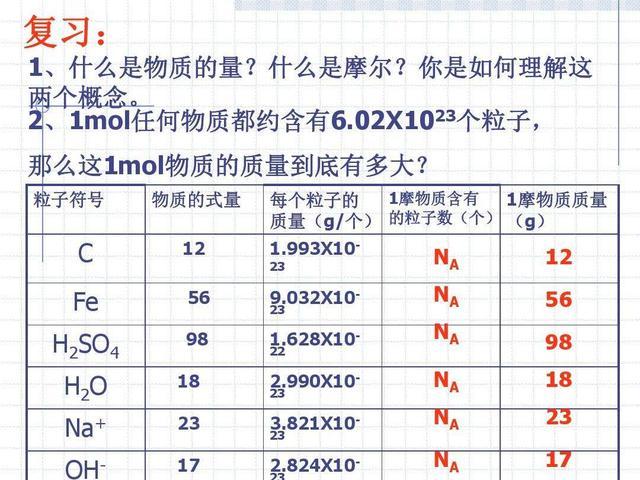
摩尔(mole),简称摩,旧称克分子、克原子,符号为mol,是物质的量的单位,是国际单位制7个基本单位之一。
每1摩尔任何物质(微观物质,如分子,原子等)含有阿伏加德罗常量(约6.02×10²³)个微粒。
使用摩尔时基本微粒应予指明,可以是原子、分子、离子及其他微观粒子,或这些微观粒子的特定组合体。
约6.02×10²³个就是1摩尔,就好比人们常说的一打就是指12个,“摩尔”和“打”一样只是一种特殊的单位量。
0.012kg(12克)¹²C(碳12)所包含的原子个数就是1摩尔。
/iknow-pic.cdn.bcebos.com/b151f8198618367adf9eb16f23738bd4b31ce569"target="_blank"title="点击查看大图"class="ikqb_img_alink">/iknow-pic.cdn.bcebos.com/b151f8198618367adf9eb16f23738bd4b31ce569?x-bce-process=image%2Fresize%2Cm_lfit%2Cw_600%2Ch_800%2Climit_1%2Fquality%2Cq_85%2Fformat%2Cf_auto"esrc="https://iknow-pic.cdn.bcebos.com/b151f8198618367adf9eb16f23738bd4b31ce569"/>
摩尔的发展历史
摩尔是在1971年10月,有41个国家参加的第14届国际计量大会决定增加的国际单位制(SI)的第七个基本单位。
摩尔应用于计算微粒的数量、物质的质量、气体的体积、溶液的浓度、反应过程的热量变化等。
摩尔来源于拉丁文moles,原意为大量、堆积。
1971年第十四届国际计量大会关于摩尔的定义有如下两段规定:“摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg碳—12的原子数目相等。”。
“在使用摩尔时应予以指明基本单元,它可以是原子、分子、离子、电子及其他粒子,或是这些粒子的特定组合。”。
上两段话应该看做是一个整体。0.012kg碳—12核素所包含的碳原子数目就是阿伏伽德罗常数(NA),目前实验测得的近似数值为NA=6.02×10²³。
摩尔跟一般的单位不同,它有两个特点:
①它计量的对象是微观基本单元,如分子、离子等,而不能用于计量宏观物质。
②它以阿伏加德罗数为计量单位,是个批量,不是以个数来计量分子、原子等微粒的数量。
也可以用于计量微观粒子的特定组合,例如,用摩尔计量硫酸的物质的量,即1mol硫酸含有6.02×10²³个硫酸分子。
摩尔是化学上应用最广的计量单位,如用于化学反应方程式的计算,溶液中的计算,溶液的配制及其稀释,有关化学平衡的计算,气体摩尔体积及热化学中都离不开这个基本单位。
1摩尔是什么概念
一摩尔等于6.02×10^23个分子。
根据题意,结合摩尔的知识进行分析解答,1mol任何物质都约含有6.02×10(23)次方个微粒,构成物质的微粒有分子、原子和离子,所以这些物质的组成可能是分子、也可能是原子和离子,并非只局限于分子一种说法。
关于摩尔的具体含义
使用摩尔时基本微粒应予指明,可以是原子、分子、离子、原子团、电子、质子、中子及其他粒子,或这些粒子的特定组合。
国际上规定,1mol粒子集体所含的粒子数为6.02×10²³个,0.012kg¹²C(碳-12)中所含的碳原子数也等于6.02×10²³个,所以,一摩尔物质所包含的结构粒子的数目等于0.012kg¹²C(碳12)所包含的原子个数。
有时,把一摩尔物质的质量称为该物质的摩尔质量,用符号M表示,如氢气H2的M=2.02×10⁻³kg。
质量F为M的物质,M与μ之比称为该物质的物质的量(又称摩尔数),=Mμ。
例如M=4.04×10⁻³kg氢气H₂的摩尔数=2。









还没有评论,来说两句吧...