原子核外电子排布遵循三个原则:能量最低原理、泡利不相容原理和洪特规则。
1、能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道。
这是因为原子核外电子的排布要遵循一系列的能级,这些能级按照能量从低到高的顺序排列。
在原子核外电子排布的过程中,电子总是优先占据能量较低的轨道,这样可以减少电子的能量,使其更加稳定。
2、泡利不相容原理:在同一原子中,不可能有四个量子数完全相同的电子存在。这个原则可以用来解释原子核外电子排布的规律和特点,帮助我们理解不同原子和分子的电子云分布和化学反应性质。
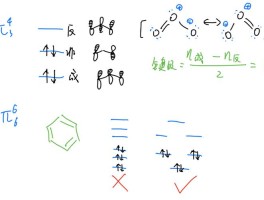
3、洪特规则:在原子核外电子排布的过程中,电子优先以单数自旋的方向进入轨道,其次是双数自旋的方向。
在等价轨道上排布的电子将尽可能分占不同的轨道,且自旋方向相同。
这个原则可以用来解释原子核外电子排布的规律和特点,帮助我们理解不同原子和分子的电子云分布和化学反应性质。
原子核的构成方式:
原子核是原子的核心部分,由质子和中子构成。质子带有正电荷,中子不带电,它们的数量决定了原子的元素种类和核子的质量。
在原子核中,质子和中子通过强相互作用力相互结合在一起,形成一种相对稳定的状态。强相互作用力是一种非常强大的力,它能够在极小的距离内起作用,并且只存在于原子核内部,是维持原子核稳定的关键。
值得一提的是,原子核中的质子和中子的数量并不是随意的,它们必须遵循一定的规律,即核子的质量数和原子序数必须相等。
此外,不同元素的原子核还具有不同的核子结构和性质,这些差异决定了元素之间的化学性质和物理性质的不同。
泡利不相容原理是什么?
泡利不相容原理(Pauli’sexclusionprinciple)指在原子中不能容纳运动状态完全相同的电子。
又称泡利原子、不相容原理。
一个原子中不可能有电子层、电子亚层、电子云伸展方向和自旋方向完全相同的两个电子。
如氦原子的两个电子,都在第一层(K层),电子云形状是球形对称、只有一种完全相同伸展的方向,自旋方向必然相反。
每一轨道中只能客纳自旋相反的两个电子,每个电子层中可能容纳轨道数是n2个、每层最多容纳电子数是2n2。
核外电子排布遵循泡利不相容原理、能量最低原理和洪特规则.能量最低原理就是在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.后来量子力学证明,电子这样排布可使能量最低,所以洪特规则可以包括在能量最低原理中,作为能量最低原理的一个补充.。
自旋为半整数的粒子(费米子)所遵从的一条原理。
简称泡利原理。
它可表述为全同费米子体系中不可能有两个或两个以上的粒子同时处于相同的单粒子态。
电子的自旋,电子遵从泡利原理。
1925年W.E.泡利为说明化学元素周期律提出来的。
原子中电子的状态由主量子数n、角量子数l、磁量子数ml以及自旋磁量子数ms所描述,因此泡利原理又可表述为原子内不可能有两个或两个以上的电子具有完全相同的4个量子数n、l、ml、ms。
根据泡利原理可很好地说明化学元素的周期律。
泡利原理是全同费米子遵从的一条重要原则,在所有含有电子的系统中,在分子的化学价键理论中、在固态金属、半导体和绝缘体的理论中都起着重要作用。
后来知道泡利原理也适用于其他如质子、中子等费米子。
泡利原理是认识许多自然现象的基础。
最初泡利是在总结原子构造时提出一个原子中没有任何两个电子可以拥有完全相同的量子态。
一个由个费米子组成的量子系统波函数完全反对称和是第个费米子的位置和自旋,是置换算符,其作用是对换两个粒子









还没有评论,来说两句吧...